Next Generation Sequencing – Hvilke typer undersøgelser er der?
Indsigt i sekvensen af vores genetiske materiale kan være meningsfyldt og har medført, at vi i dag forstår årsager til sygdomme på en helt anden måde end hidtil.
Sekventering er processen, hvorved rækkefølgen af nukleotiderne Adenin (A), Guanin (G), Cytosin (C) og Thymin (T) bliver bestemt. Disse nukleotider udgør den primære struktur af vores genetiske kode (fra engelsk deoxyribonucleic-acid, DNA). Kendskab til sammensætningen og rækkefølgen af nukleotider i DNA’et kan assistere med værdifuld viden til diagnostik og behandling af sygdomme.
Udviklingen af sekventeringsteknologien har været med til at muliggøre brugen af nyere molekylære metoder til brug inden for diagnosticering samt individuelle behandlings-strategier, der anvendes i dag (personlig medicin). Dette har resulteret i, at personlig medicin, baseret på genetiske undersøgelser, gradvist bliver mere og mere implementeret i kliniske sammenhænge. Med lanceringen af Next-Generation Sequencing-teknologien ((NGS) blev det muligt at imødekomme efterspørgslen efter både hurtigere og billigere sekventeringsteknologi end den tidligere anvendte Sanger-Sekventering (Sanger et al., 1977).1
NGS-teknologien har gjort det muligt at bestemme rækkefælgen af nukleotider i millioner af reaktioner på få dage fra bestilling af analyse til endeligt resultat. NGS er præsenteret ved flere applikationer, heriblandt: Whole Genome Sequencing (WGS) (hel-genom-sekventering); Whole Exome Sequencing (WES) (hel-exom-sekventering) og Targeted Exome Sequencing (TES) (gen-panels-sekventering, der kan være exom-sekventering af udvalgte gener, eventuelt kombineret med hot spot-sekventering for bestemte ændringer i udvalgte gener). Disse er alle NGS-analyser, der bruges afhængigt af, hvad der ønskes undersøgt. Valget mellem WGS, WES og TES bør derfor altid nøje overvejes for at sikre det bedste resultat til brug på det rette tidspunkt til patientens diagnostik, behandling og/eller opfølgning.
Muligheder ved sekventering
Det menneskelige genom er sammensat af ca. 3 milliarder nukleotider, hvoraf omkring 1,5% indeholder protein-kodende gener (kaldet exomet).2 Mutationer introduceret i disse gener kan medvirke til ændret celleaktivitet (loss-of-function-mutationer/gain-of-function-mutationer) af proteiner, der er vigtige for homøostase. Dette er mutationer som potentielt kan lede til udviklingen af kræft. Mutationer er defineret som ”driver”-mutationer, såfremt mutationen har en fænotype, der bidrager til en fordel i cellulær proliferation og/eller cellulær overlevelse.3 Foruden ”driver”-mutationer er genomet fyldt med ”passenger”-mutationer. Disse er repræsenteret ved tusindvis af mutationer, der ikke udviser en direkte fænotype eller cellulær fordel.4 Ved 80% af kræfttilfælde er sygdommen multifaktoriel med somatiske mutationer (mutationer fundet ved undersøgelse af kræftvæv) fundet i sygdomsrelaterede gener.5 De resterende 20% skyldes arvelige mutationer i sygdomsrelaterede gener.5
Identifikation af mutationer i årsagsgivende sygdomsgener er vigtige at få identificeret og undersøgt til den videre forståelse af sygdomme, heriblandt kræft. Det overordnede formål bag sekventering er at undersøge, om der er mutationer i DNA fra patientens kræftknude. I en sekventering undersøges der for forskellige typer af mutationer: Single nukleotid variationer (SNV), insertioner/deletioner (indels), copy number variationer (CNV), strukturelle variationer (SV), som ideelt skal identificeres (annoteres) med høj sensitivitet (sande positive) og høj specificitet (sande negative).6
Hel-genom-sekventering (WGS)
En generel antagelse ved sekventering er, at jo bredere sekventeringsundersøgelsen er, desto lavere sekventeringsdybde kan der forventes. Ved WGS bliver hele genomet sekventeret med en gennemsnitlig dybde på 30-50x.7 WGS er ideel til at identificere SV samt CNV på tværs af hele genomet.7 Dog kan WGS udvise manglende tilstrækkelighed i at detektere sjældne/lav-frekvens somatiske mutationer fundet i et cancer-genom. Dette er som en konsekvens af den lave sekventeringsdybde, hvorfor WGS med fordel kan anvendes eksplorativt pegende mod etablering af ny viden om en sygdom. Et overblik over WGS kan ses i figur 1A.
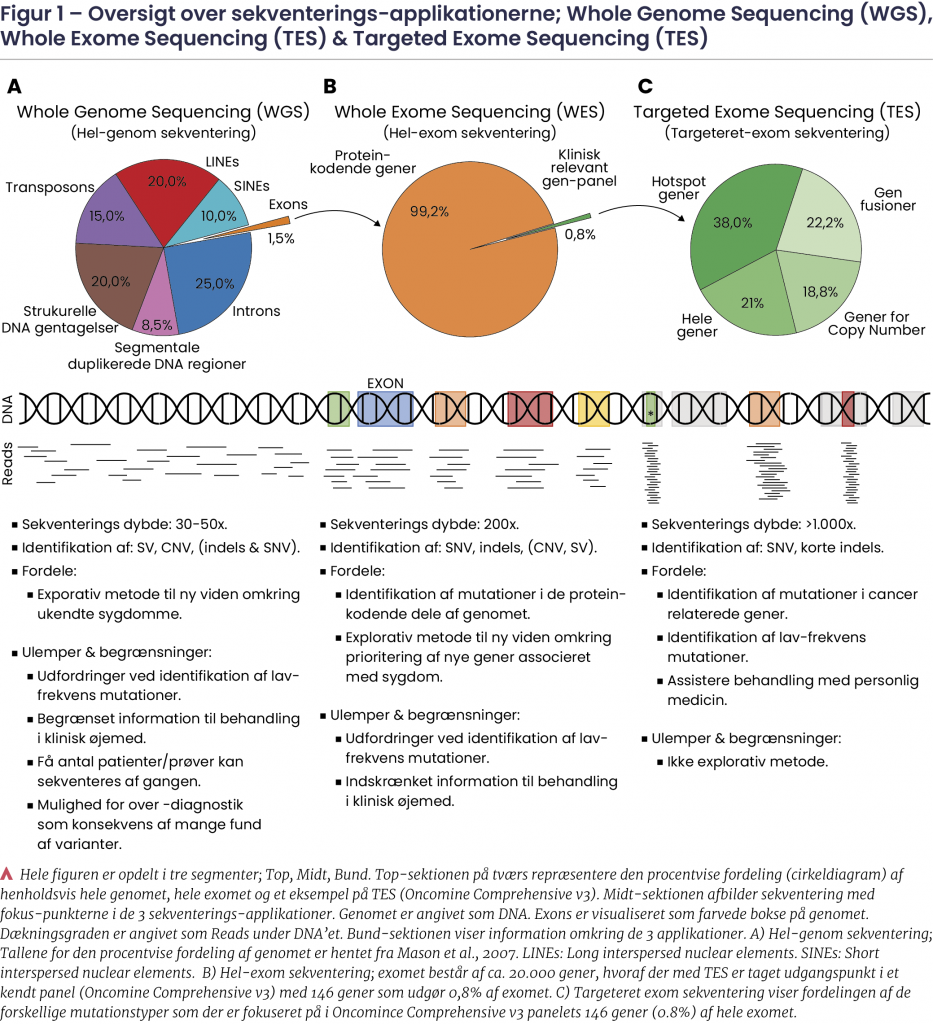
Hel-exom-sekventering (WES)
Biologisk behandling, der er tilgængelig i dag, er udelukkende rettet mod mutationer i de protein-kodende gener i genomet (WES), hvorfor information fundet i de ikke-kodende dele (introns) og supplerende elementer af genomet indtil videre giver begrænset information i en klinisk sammenhæng. Ved WES undersøges omkring 20.000 gener, hvilket muliggør en gennemsnitlig sekventeringsdybde på 200x.8 Da mutationer associeret med kræft indtil nu er lokaliseret i de kodende dele af gener (exons), er WES en fordelagtig metode at benytte til at identificere og prioritere mulige mutationer for både behandling og yderligere forskning i et bredt spektrum af gener. Et overblik over WES kan ses i figur 1B.
Targeteret Exom-Sekventering (TES)
TES anvendes til fokuseret undersøgelse af udvalgte gener med fokus på bestemte områder og regioner i gener associeret med kræft til brug for diagnosticering og behandling/opfølgning. TES-analysen er derfor målrettet til et antal udvalgte gener og muliggør derved en sekventeringsdybde på mere end 1000x.8 Dette betyder, at somatiske varianter med en forekomst ned til 5% i en population af celler kan detekteres. TES er yderst udbredt i klinisk henseende til f.eks. afklaring om overvejelser ved targeteret/personlig/individualiseret behandling afstemt efter fund ved sekventering. TES bruges ikke til identifikation af SV grundet det begrænsede antal gener, der indgår i undersøgelsen. Et overblik over TES kan ses i figur 1C.
Målrettet behandling
Nye biologiske behandlinger inden for kræft kræver en specifik mutation (et target), for at patienten kan tilbydes behandling. Præcis annotering (beskrivelse af den fundne mutation) med høj sensitivitet og høj specificitet er en forudsætning for forventet optimal effekt af den givne biologiske behandling. Begrænset viden om sande mutationer vil være medvirkende til ”one-size-fits-all”-behandlinger,9 medens kendskab til targets (mutationer) for effektive biologiske behandlinger vil kunne øge brugen af personlig medicin. For eksempel vil patienter med en patogen BRCA-1-mutation fundet ved æggestokskræft10 samt brystkræft11 kunne tilbydes behandling med en PARP-hæmmer.
En anden type af biologisk behandling er via signalhæmmere. Disse bruges til at mindske signaleringen fra ydersiden af cellen til indersiden af cellen for dermed at mindske celledeling/cellevækst. Patienter med tyk- og endetarmskræft med fund af mutationer i RAS-generne har som udgangspunkt gavn af denne signaleringshæmmer, da mutationer gør, at den videre signalering sker uhæmmet på indersiden af cellen.12 Da fund af mutationer kan have afgørende betydning for behandlingsvalg, er sekventeringsdybden et vigtigt redskab til med sikkerhed at identificere mutationer, der kan være til stede, omend i et begrænset antal celler i kræftvævet. WGS og WES er vigtige applikationer, der kan bidrage til dybere kendskab til den basale udvikling af sygdomme. Applikationerne kan ligeledes medvirke til at øge vores viden om potentielle mutationsfund, hvortil der eventuelt kan designes nye lægemidler, hvilket vil kunne bidrage til nye behandlingsmuligheder for fremtidens patienter.
Konklusion
Sekventering er en omfattende undersøgelse til besvarelse af forskellige spørgsmål i et behandlingsforløb. NGS-metodens forskellige applikationer (WGS, WES, TES) er ikke universale og kan derfor ikke erstatte hinanden. Det bør derfor i hver enkelt situation nøje vurderes, hvilken applikation der er den optimale på det tidspunkt i patientforløbet, hvor den ønskes anvendt.
-
Interessekonflikter
Ingen.
-
Referencer
- Metzker ML. Sequencing technologies – the next generation. Nat Rev Genet. 2010;11(1): 31-46.
- Pertea M, Shumate A, Pertea G, et al. CHESS: A new human gene catalog curated from thousands of large-scale RNA sequencing experiments reveals extensive transcriptional noise. Genome Biol. 2018;19(1): 1-14.
- Pon JR, Marra MA. Driver and passenger mutations in cancer. Annu Rev Pathol Mech Dis. 2015;10: 25-50.
- McFarland CD, Mirny LA, Korolev KS. Tug-of-war between driver and passenger mutations in cancer and other adaptive processes. Proc Natl Acad Sci U S A. 2014;111(42): 15138–15143.
- Futreal PA, Coin L, Marshall M, et al. A census of human cancer genes. Nat Rev Cancer. 2004;4(3): 177-183.
- Vestergaard, LK, Oliveira, DNP, Høgdall, CK, et al. Next Generation Sequencing Technology in the Clinic and Its Challenges. Cancers (Basel). 2021;13(1751): 1-18.
- Griffith M, Miller CA, Griffith OL, et al. Optimizing Cancer Genome Sequencing and Analysis. Cell Syst. 2015;1(3): 210-223.
- Bewicke-Copley F, Arjun Kumar E, Palladino G, et al. Applications and analysis of targeted genomic sequencing in cancer studies. Comput Struct Biotechnol J. 2019;17: 1348-1359.
- Kumar KR, Cowley MJ, Davis RL. Next-Generation Sequencing and Emerging Technologies. Semin Thromb Hemost. 2019;45(7): 661-673.
- Cortez AJ, Tudrej P, Kujawa KA, et al. Advances in ovarian cancer therapy. Cancer Chemother Pharmacol. 2018;81(1): 17-38.
- E. Caulfield, C. Davis, F. Byers. Olaparib: A Novel Therapy for Metastatic Breast Cancer in Patients With a BRCA1/2 Mutation. J Adv Pract Oncol. 2019;10(2): 167-74.
- Maus MKH, Grimminger PP, Mack PC, et al. KRAS mutations in non-small-cell lung cancer and colorectal cancer: Implications for EGFR-targeted therapies. Lung Cancer. 2014;83(2): 163–167.
Brænder du for at skrive?
Vil du gerne dele din forskning eller dine kliniske erfaringer med dine kollegaer inden for netop dit speciale? Har du en ide til en artikel, som du gerne vil udgive hos os? Send redaktionen en mail på redaktion@bpno.dk
Send mail til redaktionen